La maladie de Menkès est une pathologie rare d’origine génétique qui induit un déficit en cuivre fatal pour les enfants (décès avant l’âge de trois ans). Malheureusement, il n’existe à l’heure actuelle aucun traitement médicamenteux disponible sur le marché. Deux laboratoires de l’UL (le NGERE et le CITHEFOR) développent depuis 4 ans un transporteur synthétique capable de véhiculer le cuivre jusqu’au cerveau. Le nanotransporteur synthétisé est stable, biocompatible, non toxique et efficace. Une procédure réglementaire accélérée est actuellement en discussion avec l’Agence Européenne des Médicaments et le consortium espère une demande d’autorisation de mise sur le marché pour 2023.
Les laboratoires impliqués
A l’initiative du Professeur Feillet (UMR 1256 NGERE INSERM dirigé par le Pr JL Guéant), Service de Médecine Infantile du CHRU de Nancy-Brabois et coordonnateur du Centre de Référence des Maladies Héréditaires du Métabolisme de Nancy, les Professeurs F. Feillet, A. Boudier et I. Clarot (directrice et directeur adjoint de l’EA 3452 CITHEFOR) développent un nouveau médicament pour le traitement d’une maladie orpheline, la maladie de Menkès.
La collaboration entre le Pr Feillet et le laboratoire CTRS a été permise grâce à l’action de le Fondation Maladies Rares, plus précisément c'est grâce à leur dispositif d’accompagnement gratuit, appelé « Club POC » que le Pr Feillet a pu être mis en lien avec le laboratoire CTRS, à la demande de la SATT SAYENS.
La maladie de Menkès
La maladie de Menkès est une pathologie rare d’origine génétique dont l’occurrence est d’une naissance sur 300 000, soit deux ou trois naissances chaque année en France. La maladie de Menkès induit un déficit en cuivre. Le cuivre est un oligo-élément clé pour la survie des patients. Cette maladie orpheline se caractérise par un problème grave de fonctionnalité d’une protéine spécifique, l’ATPase 7A qui permet le passage du cuivre au niveau intestinal et au niveau de la barrière hémato-encéphalique. De ce fait, le cuivre apporté par l’alimentation ou par la voie sanguine est incapable de passer de l’intestin vers le sang mais également du sang vers le cerveau. Ce déficit entraine des conséquences dramatiques pour le patient en particulier en termes de dommages cérébraux, d’absence de développement normal de l’encéphale jusqu’au décès. Il n’existe aucun traitement efficace à l’heure actuelle et le pronostic de cette maladie est dramatique car la durée de vie des enfants concernés est inférieure à 3 ans.
Le médicament innovant
Les nanoparticules posent de nombreux problèmes de santé publique car leur dimension extrêmement petite (0.2 - 100 nm) leur confère la propriété remarquable de passer de nombreuses barrières biologiques par persorption (passage au travers des membranes physiologiques sans passer par les transporteurs physiologiques), notamment la barrière hémato-encéphalique. Ce mécanisme qui peut être très problématique en termes de toxicité peut devenir une voie thérapeutique si l’on maitrise la dose administrée. Ce concept est la base de l’invention d’un nouveau transporteur synthétique de cuivre développé et proposé pour le traitement de la maladie de Menkès. Les premiers résultats obtenus in vitro et in vivo démontrent que le nanotransporteur est stable, biocompatible, non toxique et surtout efficace. 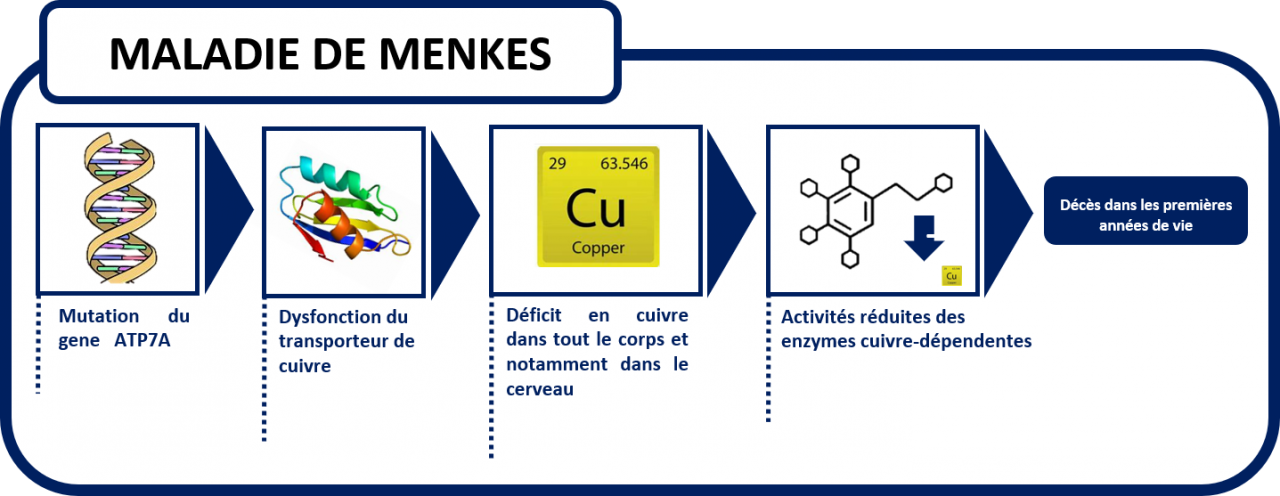
Vers une autorisation réglementaire
Ce projet de développement a commencé fin 2018 avec l’aide et l’accompagnement technique et financier (maturation) de la Société d’Accélération du Transfert de Technologie SATT SAYENS. Un premier brevet français sur la synthèse du transporteur synthétique a été déposé en 2021, son extension européenne est actuellement en cours. Le laboratoire CTRS est partenaire pour le développement pharmaceutique industriel de ce nouveau médicament. Les résultats préliminaires de l’efficacité de ce transporteur de cuivre sur un modèle murin de maladie de Menkes étant extrêmement prometteurs, les différents partenaires de l’Université de Lorraine vont demander le statut de médicament orphelin devant l’Agence Européenne du Médicament (EMA) à l’automne 2022. Avec tous les voyants au vert et une procédure réglementaire accélérée, le consortium prévoit une demande d’autorisation de mise sur le marché pour 2023.

