Les bactéries produisent à leur surface des capsules constituées de polysaccharides de haut poids moléculaire possédant une activité anti-biofilm jusqu’alors mal comprise. Des équipes de l’Institut Pasteur, du CNRS-Université de Lorraine (laboratoire LIEC, UMR7360, Nancy) et de Sanofi ont récemment publié dans la revue Nature Communications des travaux permettant d’identifier certaines propriétés moléculaires de ces polysaccharides à l’origine de leur efficacité et sélectivité d’action contre le développement de biofilms formés par des pathogènes bactériens. Ces recherches contribuent à l'objectif de développement durable "Bonne santé et bien-être" dans la mesure où elles ouvrent la voie à la synthèse de macromolécules possédant les propriétés requises pour lutter contre la formation de biofilms de bactéries pathogènes et ainsi potentiellement limiter le développement de l’antibiorésistance.
Les biofilms bactériens : une menace pour la santé et l'environnement, des solutions bio-inspirées émergent
Les communautés bactériennes fixées sur les surfaces, appelées biofilms, représentent un mode de vie très répandu jouant un rôle important dans le bon fonctionnement des écosystèmes. Cependant, la formation de biofilms est associée à l’émergence de comportement de groupe permettant aux bactéries de faire face à de nombreux stress physiques et chimiques. Dans le domaine de la santé et pour de nombreuses applications industrielles, cette tolérance vis-à-vis des traitements biocides et antibiotiques rend difficile l’élimination des biofilms. A l’origine d’infection nosocomiales et chroniques, ces biofilms accélèrent la dégradation des matériaux qu’ils colonisent, détériorent les canalisations d’eau potable et la qualité de l’eau, ou sont à l’origine d’infections alimentaires. Depuis des dizaines d’années, la communauté scientifique s’attelle à élaborer des solutions pour éradiquer ces biofilms ou inhiber leur formation, notamment par l’ingénierie de surfaces (bio)fonctionnalisées avec des composés biocides qui permettent de contrecarrer les premiers stades d’adhésion bactérienne menant au développement de biofilms. Nombre de ces surfaces biocides présentent néanmoins une efficacité anti-biofilm limitée en raison de leur rapide encrassement par des débris bactériens et organiques, ce qui réduit considérablement leur action biocide dans le temps. Ces limites ont conduit au développement de méthodes anti-biofilm bio-inspirées, ayant par exemple recours à des macromolécules d’origine biologique qui présentent une activité anti-biofilm non-biocide. C’est en particulier le cas de polysaccharides capsulaires secrétés par certaines bactéries, et qui sont impliqués dans des interactions compétitives entre bactéries.
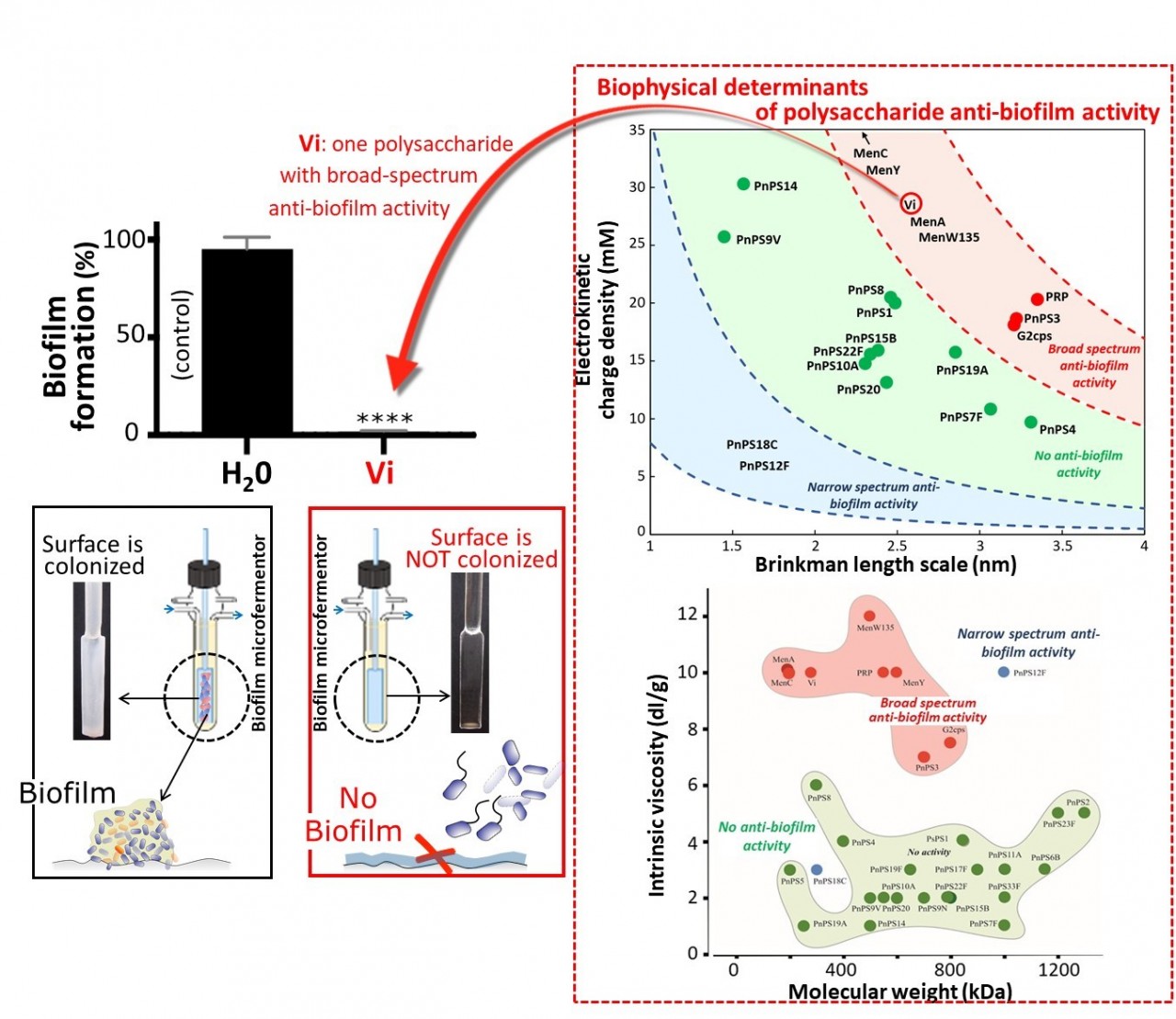
Figure 1. Classification de polysaccharides bactériens capsulaires selon leur activité anti-biofilm en fonction de leurs propriétés électrocinétiques et viscosimétriques (spectre d’action large: zone rouge dans les deux panels de droite; spectre d’action réduite: zone bleue; pas d’action: zone verte).
Des polysaccharides capsulaires pour contrôler la formation de biofilms bactériens : une nouvelle étude éclaire leurs propriétés structurales et leur activité antibiofilm
Une utilisation prophylactique de ces polysaccharides pour un contrôle de la formation de biofilms bactériens reste cependant encore limitée par un manque de connaissances de leurs propriétés physicochimiques et structurales à l’origine de leur activité anti-biofilm. Récemment, des travaux menés par des équipes de l’Institut Pasteur, du CNRS-Université de Lorraine (laboratoire LIEC, UMR7360, Nancy) et de Sanofi, publiés dans la revue Nature Communications, ont levé le voile sur les relations structure-fonction anti-biofilm de polysaccharides capsulaires identifiés au sein d’une collection de macromolécules étudiées dans le cadre de la recherche de vaccins antibactériens. Les résultats de ces travaux ont démontré un degré de sélectivité remarquable de l’activité antibiofilm de ces macromolécules, ainsi qu’à une hiérarchisation des macromolécules testées en fonction de leur spectre d’action antibiofilm (large, réduit ou absence d’activité) contre un panel d’espèces bactériennes pathogènes. Par ailleurs, en ayant recours à une batterie d’analyses physicochimiques et biochimiques, il a été mis en évidence que la spécificité d’action anti-biofilm de ces macromolécules était intimement déterminée par leurs propriétés viscométriques ainsi que leurs caractéristiques électrohydrodynamiques dérivées par l’analyse théorique de leur comportement sous champ électrique (Figure 1). Cette découverte a alors permis l’identification de nouvelles macromolécules polysaccharidiques ayant un large spectre d’activité anti-biofilm, y compris envers certains pathogènes nosocomiaux comme Escherichia coli et Staphylocoque aureus. L’étude ouvre ainsi la voie à des perspectives nouvelles pour la conception et la synthèse de macromolécules non-biocides permettant un contrôle des biofilms bactériens qui se développent dans les environnements industriels et médicaux, en particulier dans le cadre de la lutte contre les infections nosocomiales en milieu hospitalier.
Contact: Jérôme F.L. Duval; jerome.duval@univ-lorraine.fr
Lisez l'article sur Nature Communication (accès ouvert): https://www.nature.com/articles/s41467-023-37925-8
Bacterial capsular polysaccharides with antibiofilm activity share common biophysical and electrokinetic properties. Joaquín Bernal-Bayard, Jérôme Thiebaud, Marina Brossaud, Audrey Beaussart, Céline Caillet, Yves Waldvogel, Laetitia Travier, Sylvie Létoffé, Thierry Fontaine, Bachra Rokbi, Philippe Talaga, Christophe Beloin, Noëlle Mistretta*, Jérôme F.L. Duval* and Jean-Marc Ghigo*. Nature communications 14, 2553 (2023).