English version below
Les recherches récentes de l’unité mixte de service IBSLor (CNRS-Université de Lorraine-INSERM) et du laboratoire IMopa (CNRS-Université de Lorraine) sur la thématique des modifications des ARN et l'immunité innée pour combattre le virus HIV ont fait l’objet d’une publication dans le journal Nature le 9/01/2019.

Virginie Marchand, responsable de la plateforme de séquençage à haut-débit de l'UMS IBSLor et Yuri Motorin (Laboratoire IMoPA), co-auteurs de cette publication, nous parlent de ce projet.
« Qui sont les différents protagonistes de cette étude ?
Virginie Marchand : Cette étude est le fruit d’une collaboration étroite entre 3 partenaires :
- Dr Yamina Bennasser et Dr Mathieu Ringeard
Laboratoire de Virologie moléculaire (Institut de Génétique Humaine - UMR9002, CNRS-Université de Montpellier)
- Pr Yuri Motorin Laboratoire IMoPA (UMR7365, CNRS-Université de Lorraine) et Dr Virginie Marchand Unité Mixte de Service IBSLor (UMS2008 IBSLor, Plateforme de séquençage à haut-débit, CNRS-Université de Lorraine-INSERM)
du pôle Biologie Médecine Santé (BMS) de l’Université de Lorraine,
- Dr Etienne Decroly
Laboratoire Architecture et Fonction des Macromolécules Biologiques (AFMB – UMR7257, CNRS-Université d’Aix-Marseille).
Pr Yuri Motorin s’intéresse depuis de nombreuses années à l’ARN*, à ses modifications post-transcriptionnelles et aux enzymes cellulaires les catalysant. Ensemble, nous développons des techniques de pointe, combinant la biologie moléculaire et le séquençage à haut-débit, qui permettent d’identifier différentes modifications et de les analyser au sein des ARN, afin de mieux comprendre leurs fonctions encore très largement méconnues. Nous avons contacté Dr Yamina Bennasser, spécialiste en virologie moléculaire et qui s’intéresse plus particulièrement au virus de l’immunodéficience humaine (VIH), pour lui proposer d’appliquer nos développements innovants dans le contexte d’une infection par le virus de l’immunodéficience humaine (VIH).
*L’ARN est un support temporaire de l’information génétique qui pourra être traduit en protéines ; c'est donc un élément clé du vivant. Cette information est codée par un alphabet de 4 lettres qui peut être étendu après ajout de modifications chimiques sur les 4 lettres existantes constituant notre « épitranscriptome » qui permet une régulation très fine de l’expression de nos gènes.
Pouvez-vous nous en dire plus sur le sujet de cette étude ?
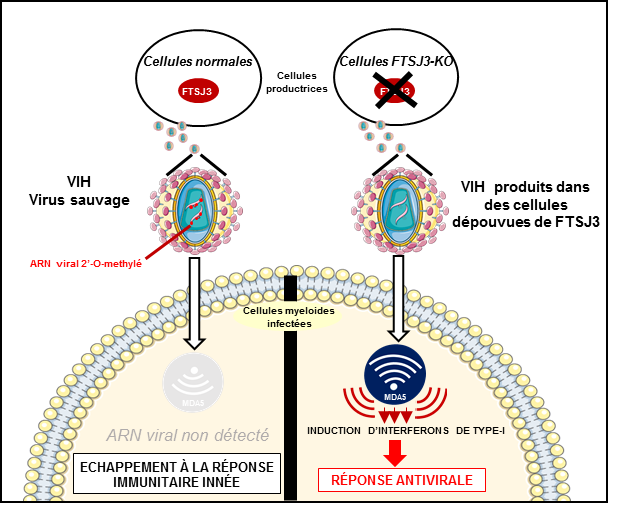
Yuri Motorin : La présence d’ARN viral dans les cellules déclenche la sécrétion d’interféron qui permet l’activation de mécanismes de défense. Malheureusement, ce n’est pas le cas du virus VIH qui ne provoque pas ou très faiblement cette réponse. Notre étude a montré que ceci est dû aux modifications post-transcriptionnelles internes qui décorent l’ARN du VIH. Comme le virus ne possède pas sa propre enzyme permettant de catalyser ces modifications, il recrute une enzyme cellulaire (FTSJ3) pour modifier son propre ARN, ce qui lui permet d’échapper aux détecteurs cellulaires qui sont capables de différencier les ARN du soi et du non-soi (immunité innée).
Quelle est la nouveauté dans les résultats ? Quelles sont les perspectives suite à cette étude ?
Yuri Motorin : C’est la première fois qu’un lien entre la présence de nucléotides modifiés internes dans l’ARN viral et l’immunité innée a été mis en évidence, ce qui ouvre évidemment de nouvelles voies d’action pour combattre le VIH. L’inhibition, même provisoire, de l’activité de l’enzyme FTSJ3 permettra d’activer les mécanismes d’éradication du virus grâce à l’immunité innée. Cette voie thérapeutique n’a pas été explorée jusque-là. »
En savoir +
FTSJ3 is an RNA 2’-O-methyltransferase recruited by HIV to avoid innate immune sensing
Mathieu Ringeard, Virginie Marchand, Etienne Decroly, Yuri Motorin and Yamina Bennasser
[English version]
Modifying its own RNA, a strategy of HIV to escape native immunity recognition
Recent research done by IBSLor (a Mixed Service Unit of the CNRS, Université de Lorraine and INSERM) and the IMoPA laboratory (CNRS – Université de Lorraine) on RNA modifications and innate immunity led to an article published in Nature on 01/09/2019
Virginie Marchand, head of the Next-Generation sequencing Core facility of IBSLor and Yuri Motorin, professor at the IMoPA lab, co-authors of this paper explain their project.
« Who are the partners involved in this study?
Virginie Marchand : There are 3 partners involved :
- Dr. Yamina Bennasser and Dr. Mathieu Ringeard
Molecular Virology Lab (Institut of Human Genetics - UMR9002, CNRS-Université de Montpellier)
- Prof. Yuri Motorin
Molecular Engineering and Articular Physiopathology Lab (IMoPA - UMR7365, CNRS-Université de Lorraine) and
Dr. Virginie Marchand
Mixed Service Unit IBSLor (UMS2008 IBSLor, Next-Generation sequencing Core facility, CNRS-Université de Lorraine-INSERM)
of pole Biologie Médecine Santé (Biology Medicine and Health) of Université de Lorraine,
- Dr. Etienne Decroly
Laboratoire Architecture et Fonction des Macromolécules Biologiques (Architecture and Biological Macromolecules Functions Lab – UMR7257, CNRS-Université d’Aix-Marseille).
Prof. Motorin has been looking into RNA* post-transcriptional modifications for many years, as well as at the cellular enzymes catalyzing those events. Together, we developed cutting edge technologies, combining molecular biology and high-throughput sequencing, enabling identification of various modifications and analyzing them in RNA, in order to better characterize their still poorly understood functions. We contacted Dr. Yamina Bennasser, specialist in molecular virology and specifically interested in the human immunodeficiency virus (HIV), to join our forces in applying innovative technologies in the context of an HIV infection.
*RNA is a temporary matrix of the genetic information which will be translated to proteins; and is therefore an essential element of any living organism. This information is encoded by a 4-letter alphabet which can be further extended by adding chemical modifications to the existing 4 letters constituting our “epitranscriptome”. This enables a very precise regulation of the gene expression.
Can you tell us more about this study?
Yuri Motorin: The presence of viral RNA in human cells triggers the secretion of interferon, which is required for the activation of native immunity defense mechanisms. Unfortunately, this isn’t the case for HIV, which elicits very limited interferon secretion. Our study demonstrated that this is due to internal post-transcriptional modifications which allow to HIV escape the detection in the cell. As the virus doesn’t have its own enzyme capable of catalyzing these modifications, it recruits a cellular protein with such activity (FTSJ3) to modify its own RNA. This allows HIV to evade intracellular detectors in charge of differentiating invading foreign RNAs from our own species (innate immunity).
 What is the novelty of these results? What are the potential outcomes of this study?
What is the novelty of these results? What are the potential outcomes of this study?
Yuri Motorin: For the first time a link has been established between the presence of internal modified nucleotides in viral RNA and innate immunity, opening new opportunities to fight HIV infection. Inhibiting, even temporarily, the activity of enzyme FTSJ3 would enable activation of our innate immune system able to eradicate the virus. Such therapeutic approach hasn’t been explored so far. »
Would you like to know more?
FTSJ3 is an RNA 2’-O-methyltransferase recruited by HIV to avoid innate immune sensing
Mathieu Ringeard, Virginie Marchand, Etienne Decroly, Yuri Motorin and Yamina Bennasser
Nature, January 9th 2019 (article in english)

