Temps de lecture : 3 minutes
Les polykétides bactériens sont des biomolécules particulièrement importantes en thérapie humaine et vétérinaire. Ils sont à la base de nombreux médicaments utilisés pour des traitements antibactériens, antifongiques, antihelminthiques, immunosuppresseurs ou encore antitumoraux. Ils trouvent également des applications dans la protection des cultures grâce à leurs propriétés insecticides, antifongiques ou herbicides.
Ces produits naturels doivent parfois être modifiés afin d’améliorer leurs propriétés et qu’ils soient en particulier adaptés pour des applications médicales. De plus, et de façon tout à fait remarquable, des travaux ont montré que certaines parties des polykétides sont superflues et que des versions simplifiées peuvent être tout aussi efficaces que les molécules originales.
Ces molécules sont produites par des complexes multienzymatiques géants, les polykétide synthases (PKS). Ces PKS présentent une architecture modulaire et fonctionnent d’une façon comparable à une chaîne d’assemblage de voitures. En effet, chaque module, constitué de différents domaines catalytiques, est responsable d’une étape d’extension aboutissant à la chaîne polykétidique finale. Dans la majorité des cas, chaque sous-unité enzymatique, formant le complexe PKS, contient plusieurs modules.
L’une des actions du projet IMPACT Biomolécules de l’I-SITE LUE avait comme objectif de développer une approche de biologie de synthèse pour produire des polykétides structurellement simplifiés. L’organisation modulaire des PKS offre en effet la perspective alléchante de créer des polykétides sur mesure par ingénierie génétique.
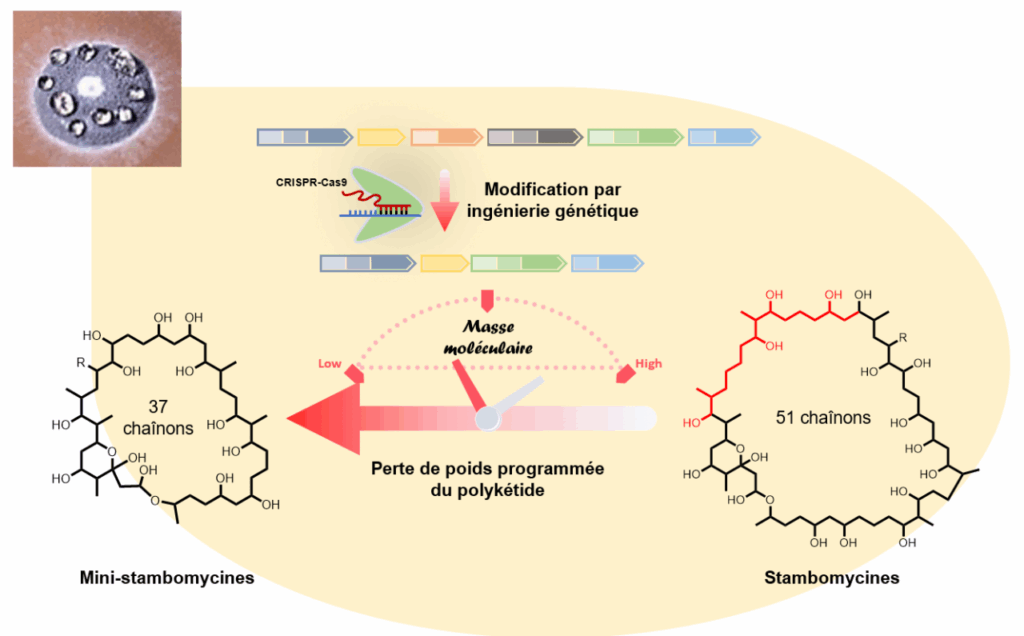
Porté par les Pr Kira J. Weissman de l’UMR UL-CNRS 7365 IMoPA (Ingénierie Moléculaire et Physiopathologie Articulaire) et Bertrand Aigle de l’UMR UL-INRAE 1128 DynAMic (Dynamique des génomes et adaptation microbienne), ce projet s’est focalisé sur un système PKS de la bactérie du sol Streptomyces ambofaciens et responsable de la synthèse des polykétides stambomycines. Ces molécules, constituées d’un macrocycle à 51 chaînons, sont parmi les polykétides les plus grands connus. De plus, elles présentent des activités anticancéreuses prometteuses.
En utilisant diverses stratégies de pointe, les travaux réalisés ont permis de retirer, directement chez la bactérie S. ambofaciens, 7 modules entiers sur les 25 que compte de la chaîne d’assemblage des stambomycines, et ainsi d’obtenir une souche mutante produisant une série de mini-stambomycines « allégées » à 37 chaînons. Ils ont également permis d’identifier plusieurs facteurs influençant l’efficacité de cette ingénierie, ce qui permettra à terme d’améliorer les rendements de production de ces polykétides à structure simplifiée. Il reste maintenant à caractériser les propriétés biologiques de ces nouvelles formes simplifiées de stambomycines.
Les résultats obtenus ouvrent donc de nouvelles perspectives à la communauté travaillant sur les polykétides pour la manipulation in vivo des PKS afin de forcer d’autres polykétides surdimensionnés à perdre du poids.
Ces travaux sont le fruit de la thèse de Li Su, une doctorante co-dirigée par Bertrand Aigle, Kira Weissman et Christophe Jacob et soutenue par LUE. Ils ont été publiés le 26 janvier dans la prestigieuse revue Nature Communications sous le titre « Engineering the stambomycin modular polyketide synthase yields 37-membered mini-stambomycins » (https://www.nature.com/articles/s41467-022-27955-z).